Нейродегенерация, прогрессирующая дегенерация нервных клеток, которая приводит к гибели нейронов, лежит в основе многих заболеваний нервной системы, включая и болезнь Паркинсона. В большинстве дегенеративных заболеваний нервной системы этот процесс идет очень медленно: на него уходят месяцы или даже годы. За это время нервные клетки уже повреждены и работают со сбоями.
Содержание
Болезнь Паркинсона: что это?
Болезнь Паркинсона – это заболевание центральной нервной системы, характеризующееся замедлением движений, тремором в конечностях и ригидностью мышц.
Название болезни принадлежит лондонскому врачу Джеймсу Паркинсону. Он первым еще в 1817 году распознал и описал симптомы этого заболевания. Болезнь Паркинсона развивается в течение многих лет, и начальные симптомы неспецифичны.
Ученые годами искали эффективную терапию для лечения этого заболевания. В последние годы появилось несколько многообещающих исследований.
Болезнь поражает мужчин больше, чем женщин. Средний возраст пациентов с болезнью Паркинсона составляет 58 лет. Но бывают случаи заболевания даже до 40 лет. В мире около 6 миллионов таких пациентов. За год от 10 до 20 человек страдают от него на каждые 100 000 человек. Статистика неутешительная. Неуклонно растущее число пожилых людей и старение общества неизбежно приведет к увеличению числа людей с болезнью Паркинсона в будущем.
Болезнь Паркинсона: симптомы
Симптомы этого заболевания развиваются медленно и постепенно в течение нескольких лет.
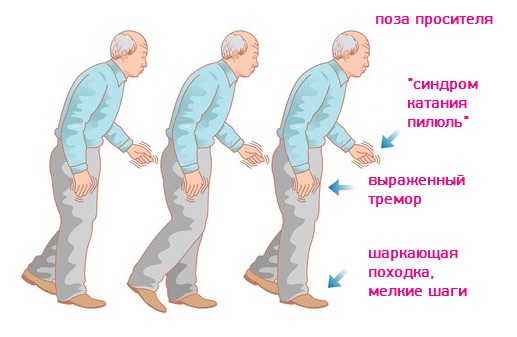
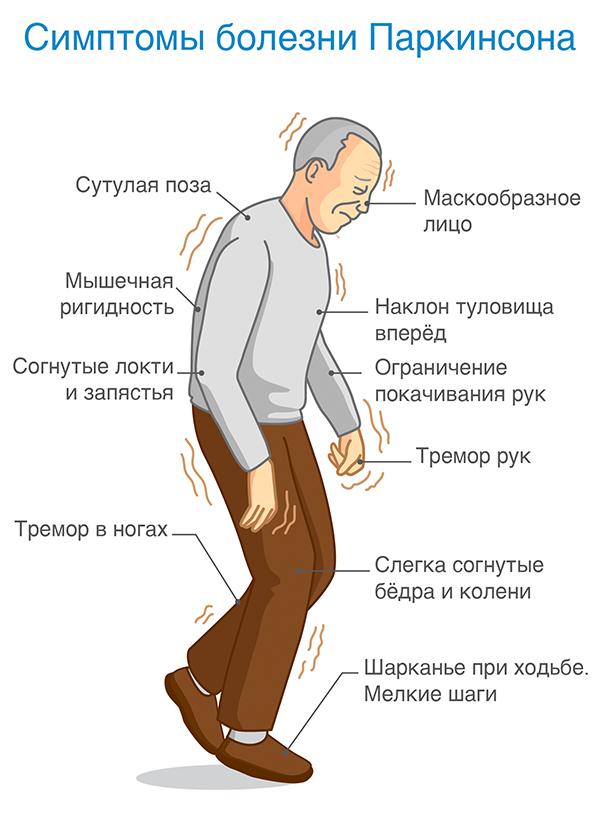
Вначале оно проявляется неспецифическим образом: слабость, утомляемость, легкая утомляемость, замедленность движений и определенная неуклюжесть в движениях. Поэтому изначально пациенты связывают эти симптомы с ревматическими изменениями или просто с пожилым возрастом.
Однако через некоторое время пациенты с болезнью Паркинсона заметят усиление этих симптомов. Например, дисбаланс и трудности с выполнением простых задач, таких как вставание со стула или с постели.
Основные симптомы заболевания:
- общее замедление движений
- наклон фигуры вперед
- дрожание рук (реже ног или головы)
- скованность (повышение тонуса) мышц (мышечная ригидность)
- проблемы с началом движения
- трудности с подъемом, с выполнением повседневных дел, таких как: мытье, прием пищи, одевание.
- шаркающая походка
Если вы заметили указанные выше симптомы у себя или своих близких, сразу записывайтесь на прием к врачу. Консультация специалиста просто необходима.
Откуда берется болезнь Паркинсона?
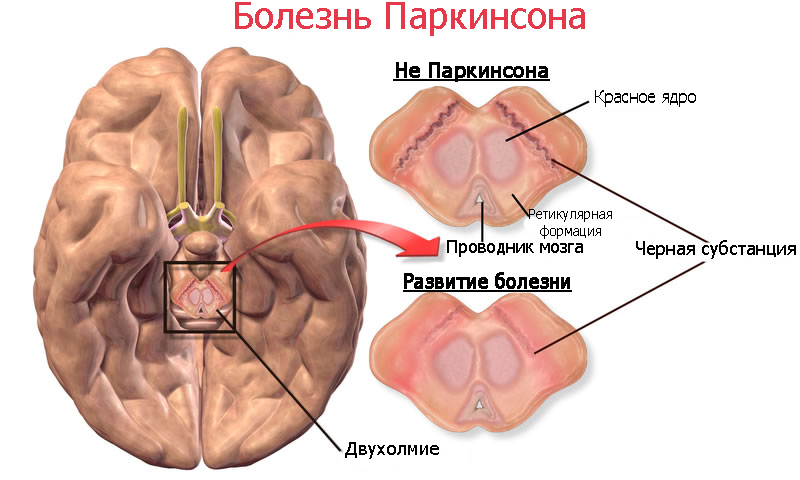
Болезнь Паркинсона вызывается гибелью нервных клеток в части мозга, называемой черным веществом. Эти нейроны обычно секретируют дофамин – химический посредник, ответственный за передачу сигналов между черной субстанцией и полосатым телом в переднем мозге. Нервные импульсы, передаваемые черной субстанцией, отвечают за произвольную работу мышц и координацию движений.
Наследственная форма болезни Паркинсона связана с мутацией гена, кодирующего синтез белка — альфа-синуклеина — компонента телец Леви. Тельца Леви обнаруживаются в цитоплазме патологически пораженных клеток диаметром 5-25 мм и состоят из ядра, содержащего неправильно свернутый белок альфа-синуклеин, окруженного слоем убиквитина, небольшого белка, обнаруженного во всех эукариотических клетках.
Тельца Леви также характерны для других нейродегенеративных заболеваний и, вероятно, используются для удаления несовпадающих белков (в данном случае альфа-синуклеина).
Поскольку мозг обладает высокой компенсирующей способностью, симптомы Паркинсона не проявляются до тех пор, пока не умрут около 85% клеток, продуцирующие дофамин.
Используются многие медикаментозные препараты. Наиболее важным из них является предшественник дофамина – леводопа (L-ДОФА – левовращающий изомер аминокислоты дезоксифенилаланина).
Как уже упоминалось, симптомы болезни Паркинсона вызваны дегенерацией нервных клеток, вырабатывающих дофамин. Здоровые нейроны производят этот нейромедиатор в несколько этапов. Во-первых, они превращают тирозин (аминокислоту) в L-ДОФА, а затем в дофамин. Он накапливается в нейронах, в синаптических везикулах и при стимуляции высвобождается в синаптическое пространство.
Высвободившийся дофамин стимулирует рецепторы, расположенные на постсинаптической мембране, тем самым передавая импульс другим нервным клеткам. После попадания в синаптическое пространство, нейромедиатор частично расщепляется ферментами, называемыми СОМТ и МАО-В, для краткости. Затем частично возвращается обратно в пресинаптическую нервную клетку, из которой он был выпущен.
Болезнь Паркинсона: лечение
Первая стратегия – применение L-ДОФА
Стратегии лечения болезни Паркинсона связаны с влиянием на этапы синаптической передачи, описанные выше. Они пытаются восполнить дефицит дофамина, остановить процесс разложения этого посланника в мозгу. Или снабдить организм веществами, стимулирующими дофаминовые рецепторы. Введение дофамина в кровь не даст никакого эффекта, поскольку он не проникает через гематоэнцефалический барьер. L-ДОФА, предшественник дофамина, проходит через этот барьер.

Открытие L-DOPA стало прорывом в борьбе с болезнью Паркинсона. Его вводят периферически вместе с ингибиторами ферментов, которые превращают его в дофамин. Это предотвращает превращение L-ДОФА в дофамин в периферической крови.
В головном мозге L-ДОФА превращается в дофамин в дофаминергических нейронах.
К сожалению, этот препарат не предотвращает гибель клеток, продуцирующих дофамин. В большинстве случаев организм пациента положительно реагирует на L-DOPA только в течение первых нескольких лет. Но по прошествии некоторого времени, когда нейроны, превращающие L-DOPA в дофамин, снижаются, необходимо увеличить дозу препарата. А это приводит к множеству нежелательных побочных эффектов.
Вторая стратегия – подавление деградации дофамина
Еще один метод лечения – подавить процесс деградации дофамина, уже высвобожденного из нейрона. Это может быть сделано путем ингибирования ферментов COMT или MAO-B, ответственных за его расщепление.
Третья стратегия – введение антогонистов дофамина
Еще одна используемая стратегия лечения – это введение агонистов дофамина – веществ, имитирующих действие дофамина. Их задача – стимулировать дофаминовые рецепторы, расположенные на нейронах головного мозга.
Стратегия хирургического лечения болезни Паркинсона
Она заключается в трансплантации клеток, способных вырабатывать дофамин. Клетки, имплантированные в мозг, могут быть клетками тела пациента (или плода человека). Использование клеток пациента оказалось неэффективным, поскольку этих клеток мало, и они быстро умирают после трансплантации.
В Швеции и США проводят процедуры имплантации мозговой ткани плода пациентам с запущенной болезнью Паркинсона. Использование эмбриональных клеток человека в терапевтических целях создает множество этических проблем и является не очень эффективным (для одной трансплантации требуется использование клеток от трех до восьми эмбрионов). Однако у ряда пациентов, прошедших лечение таким образом, наблюдается значительное улучшение. А у некоторых из них улучшение настолько велико. что они могут в основном вернуться к своей обычной деятельности.
Болезнь Паркинсона – перспективы
Как упоминалось ранее, основным признаком болезни Паркинсона является нейродегенерация дофаминергических нейронов в части мозга, известной как черное вещество. Как следствие, дофаминергический дефицит вызывает дисбаланс между нейротрансмиттерами в базальных ганглиях. В результате глутаматергическая и холинергическая системы имеют относительное преимущество перед дофаминергической системой.
По-видимому, есть основания для противопаркинсонической активности веществ, блокирующих рецепторы, стимулируемые глутаминовой кислотой. К сожалению, в то время как исследования на животных показали обнадеживающие результаты, клинические испытания с использованием блокаторов таких рецепторов не дали результатов.
Амантадин в настоящее время используют для лечения паркинсонических двигательных расстройств (таких как гипертонус, тремор), вызванных лекарствами.
Хотя точный патомеханизм дегенерации клеток черной субстанции при болезни Паркинсона не ясен, предполагается, что свободные радикалы и дисфункция митохондрий играют основную роль.
Таким образом, представляется, что при болезни Паркинсона и других нейродегенеративных заболеваний, следует также обратить особое внимание на соответствующую диету. Она должна быть богата соединениями с антиоксидантами. Например, коэнзим Q10 или Витамин Е.
Витамин С и бета-каротин также являются сильными антиоксидантами и защищают нейроны от токсического воздействия многих вредных экзогенных факторов.