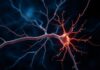
Ein Neuron ist weit mehr als nur eine winzige Zelle im Gehirn; es ist ein lebendiges Kommunikationswunder, ein elektrochemischer Stern am Himmel unserer Gedanken, Gefühle und Bewegungen. Beim ersten Blick wirkt ein Neuron wie eine kleine, unscheinbare Einheit — doch schon beim zweiten Blick offenbart sich ein Stück biologische Ingenieurskunst: verzweigte Dendriten, ein energiegeladenes Zellkörperchen, ein langer, isolierter Axon und eine hochspezialisierte Synapse, an der Informationen in geheimnisvoller Weise weitergegeben werden. In diesem Artikel werden wir Schritt für Schritt in die Funktionsweise eines Neurons eintauchen, seine Bauteile kennenlernen, die physikalisch-chemischen Prozesse verstehen, die für seine Aktivität verantwortlich sind, und einen Blick auf die größeren Netzwerke werfen, die aus Milliarden solcher Zellen bestehen.
Die Reise beginnt mit einer einfachen Frage: Wie verwandelt eine Zelle chemische Energie in elektrische Signale — und wie kapselt sie diese Signale so ein, dass sie zuverlässig Informationen über Meter und Milliardenfach verknüpft weiterleiten kann? Die Antwort liegt in einer Kombination aus Zellstruktur, Ionenkanälen, Membranpotentialen und molekularen Schaltern. Doch bevor wir uns in die Tiefe stürzen, sollten wir uns die Architektur eines Neurons genauer ansehen, denn Form und Funktion sind hier untrennbar verbunden.
Содержание
Die Architektur eines Neurons: Aufbau und Bedeutung der Komponenten
Neuronen unterscheiden sich in Form und Größe je nach Funktion und Lage im Nervensystem. Gemeinsame Grundelemente gibt es jedoch fast immer: Soma (Zellkörper), Dendriten, Axon, Axonhügel, Myelinscheide und Synapsen. Jeder dieser Teile hat eine spezifische Rolle — manche sammeln Informationen, andere verarbeiten sie, wieder andere leiten sie weiter. Zusammen bilden sie ein winziges Informationsverarbeitungssystem, das in Netzwerken organisiert ist und komplexe Funktionen wie Wahrnehmung, Erinnerung und Verhalten ermöglicht.
Der Zellkörper, oder das Soma, enthält den Zellkern und die meisten Organellen. Er ist die stoffwechselaktive Zentrale, versorgt die Zelle mit Energie und synthetisiert die benötigten Proteine. Dendriten genießen die Rolle der Empfänger: Sie verästeln sich wie Bäume, fangen Signale von benachbarten Zellen ein und führen sie zum Soma. Oft sind Dendriten mit vielen kleinen Ausstülpungen, sogenannten Dornfortsätzen oder „spines“, besetzt — dort sitzen die meisten chemischen Synapsen. Das Axon ist die schnelle Leitungsbahn: Manche Axone messen nur wenige Mikrometer, andere erstrecken sich über einen Meter — etwa vom Rückenmark bis zur Fußmuskulatur. Am Axonende befinden sich die präsynaptischen Endigungen, die Neurotransmitter freisetzen, wenn ein Signal ankommt.
Der Axonhügel ist der wichtigste Punkt für die Entscheidung „Feuern oder nicht?“. Er summiert die eingehenden Signale und entscheidet, ob ein Aktionspotenzial ausgelöst wird. Myelinscheiden, gebildet von Gliazellen (Oligodendrozyten im ZNS, Schwann-Zellen im PNS), isolieren das Axon und ermöglichen saltatorische Leitung — ein Phänomen, bei dem elektrische Erregung von Knoten zu Knoten „springt“, was die Leitungsgeschwindigkeit drastisch erhöht.
Gliederung der Hauptkomponenten
Jeder dieser Bestandteile ist nicht nur funktional, sondern auch adaptiv. Dendriten können neue Verzweigungen bilden, Synapsen können verstärkt oder abgeschwächt werden, und Axone können sich in ihrer Leitfähigkeit ändern. Diese Anpassungsfähigkeit ist die Grundlage neuronaler Plastizität, dem physikalischen Substrat für Lernen und Gedächtnis.
Elektrophysik des Neurons: Ruhepotential, Ionenflüsse und Aktionspotential
Jedes Neuron ist ein Mini-Kraftwerk, das ein elektrisches Potential über seine Membran aufrechterhält. Das Ruhepotential entsteht durch ungleiche Verteilung von Ionen (vor allem Natrium Na+, Kalium K+, Chlorid Cl- und organischen Anionen) und durch die Aktivität der Natrium-Kalium-Pumpe (Na+/K+-ATPase), die drei Na+-Ionen nach außen und zwei K+-Ionen nach innen transportiert. Dadurch wird eine negative Innenseite erzeugt — typischerweise zwischen −60 und −80 Millivolt.
Wenn eingehende Signale die Membran lokal depolarisieren, öffnen sich spannungsabhängige Natriumkanäle. Ein plötzlich hoher Na+-Einstrom führt zur schnellen Depolarisation: das Aktionspotential ist geboren. Dieses alles-oder-nichts-Signal erreicht typischerweise +30 bis +40 mV. Kurz darauf öffnen sich spannungsabhängige Kaliumkanäle, K+ strömt aus, und Repolarisation sowie oft eine kurzzeitige Hyperpolarisation (nachhyperpolarisation) treten ein. Die Na+/K+-Pumpe und andere Transportmechanismen stellen schließlich das Ruhepotential wieder her.
Die zeitliche und räumliche Summation von EPSPs (exzitatorische postsynaptische Potentiale) und IPSPs (inhibitorische postsynaptische Potentiale) am Axonhügel entscheidet, ob die Depolarisation den Schwellenwert erreicht. EPSPs ergeben sich zumeist aus der Öffnung von Na+- oder Ca2+-kanälen durch Neurotransmitter, während IPSPs häufig Cl−- oder K+-leitende Kanäle betreffen.
Intermezzo: Saltatorische Leitung und Myelinisierung
Eine sehr elegante Lösung der Natur ist die Myelinscheide. An den Ranvier’schen Schnürringen, also den nichtmyelinisierten Abschnitten, „springen“ Aktionspotentiale von Knoten zu Knoten. Dies reduziert den Energieaufwand, da Ionenströme und damit Ionenaustausch auf weniger Membranfläche beschränkt werden, und erhöht zugleich die Leitungsgeschwindigkeit dramatisch.
Synaptische Übertragung: Chemische und elektrische Synapsen
Die Synapse ist der magische Ort der Kommunikation zwischen zwei Neuronen. Chemische Synapsen arbeiten über Neurotransmitter: Ein eintreffendes Aktionspotential führt in der präsynaptischen Endigung zur Öffnung von spannungsabhängigen Calciumkanälen. Ca2+ strömt ein und initiiert die Fusion von Vesikeln mit der präsynaptischen Membran, wodurch Neurotransmitter in den synaptischen Spalt freigesetzt werden. Diese binden an Rezeptoren auf der postsynaptischen Membran und verändern deren Leitfähigkeit. Die Wirkung kann exzitatorisch oder inhibitorisch sein — abhängig vom Typ des Neurotransmitters und des Rezeptors.
Elektrische Synapsen hingegen erlauben direkten Ionentransfer durch Gap Junctions. Sie sind schneller, weniger modulierbar und finden sich oft in Netzwerken, die eine synchrone Aktivität benötigen, wie bestimmten Hirnarealen oder im Herzen.
Liste 1: Wichtige Schritte der chemischen synaptischen Übertragung
- Ankommen des Aktionspotentials in der präsynaptischen Endigung.
- Öffnung spannungsabhängiger Calciumkanäle und Ca2+-Einstrom.
- Ca2+-abhängige Vesikelfusion und Freisetzung von Neurotransmittern in den synaptischen Spalt.
- Bindung des Neurotransmitters an postsynaptische Rezeptoren und Öffnung oder Schließung von Ionenkanälen.
- Postsynaptische Potentiale (EPSP/IPSP) und deren Integration am Axonhügel.
- Entfernung des Neurotransmitters durch Wiederaufnahme (Reuptake), Enzymabbau oder Diffusion.
Neurotransmitter und Rezeptortypen: Chemische Vielfalt für feine Steuerung
Neurotransmitter sind die Botenstoffe des Nervensystems, und ihre Vielfalt erlaubt differenzierte Signale. Zu den bekannten gehören Glutamat (häufig exzitatorisch), GABA (häufig inhibitorisch), Acetylcholin, Dopamin, Serotonin, Noradrenalin, Glycin und zahlreiche Peptide wie Substanz P. Die Rezeptoren, an die diese Stoffe binden, sind entweder ionotrop (Liganden-gesteuerte Ionenkanäle) oder metabotrop (G-Protein-gekoppelte Rezeptoren), wobei ionotrope Rezeptoren schnelle, kurzlebige Effekte vermitteln und metabotrope Rezeptoren langsame, modulare Prozesse initiieren.
Der gleiche Neurotransmitter kann an verschiedenen Rezeptoruntertypen unterschiedliche Effekte hervorrufen. Glutamat zum Beispiel wirkt über AMPA- und NMDA-Rezeptoren — AMPA erzeugt schnelle EPSPs, NMDA hingegen ist Calcium-permeabel und spielt eine Schlüsselrolle bei synaptischer Plastizität.
Beispiel-Tabelle 1: Auswahl an Neurotransmittern und Funktionen
| Nr. | Neurotransmitter | Hauptwirkung | Beispiel für Funktion |
|---|---|---|---|
| 1 | Glutamat | Exzitatorisch | Synaptische Plastizität, Lernen |
| 2 | GABA | Inhibitorisch | Regulation der Erregbarkeit, Schlaf |
| 3 | Dopamin | Modulatorisch | Belohnung, Motivation, Motorik |
| 4 | Serotonin | Modulatorisch | Stimmung, Appetit, Schlaf |
| 5 | Acetylcholin | Exzitatorisch/Modulatorisch | Muskelkontraktion, Aufmerksamkeit |
Synaptische Plastizität: Wie Neuronen lernen und erinnern
Das Gehirn verändert sich mit Erfahrung. Diese Plastizität auf synaptischer Ebene ist das molekulare Fundament für Lernen und Gedächtnis. Langzeitpotenzierung (LTP) und Langzeitdepression (LTD) sind zwei Schlüsselmechanismen: Bei LTP verstärken wiederholte, koordinierte synaptische Aktivität die Synapse, häufig durch erhöhte AMPA-Rezeptor-Expression und strukturelle Veränderungen an den Dendritensporen. LTD hingegen schwächt Synapsen und kann durch unterschiedliche Aktivitätsmuster ausgelöst werden.
Hebb’sche Prinzipien — „Neurone, die zusammen feuern, verbinden sich“ — fassen die Idee zusammen, dass synchrone Aktivität die Verbindung stärkt. Auf molekularer Ebene spielen NMDA-Rezeptoren, Calcium-Signale, Kinase-Aktivität (z. B. CaMKII) und langfristige Veränderungen in der Genexpression eine Rolle.
Liste 2: Mechanismen synaptischer Plastizität
- Posttranslational Modifikationen (z. B. Phosphorylierung von Rezeptoren)
- Einbau oder Entfernen von postsynaptischen Rezeptoren
- Änderungen in der Vesikelfreisetzung (präsynaptische Mechanismen)
- Strukturelle Veränderungen (Dendritenwachstum, Spine-Formänderungen)
- Genregulation und Synthese neuer Proteine
Neurale Netzwerke: Vom einzelnen Neuron zum Gehirn
Ein einzelnes Neuron ist mächtig, aber seine wahre Bedeutung entfaltet sich im Netzwerk. Verschiedene Neuronen bilden Schaltkreise mit unterschiedlichen Topologien: Feedforward-Netzwerke, Rückkopplungsschleifen, modulare Cluster, Hemm-Exzitator-Balance-Systeme und rhythmische Oszillatoren. Die Balance zwischen Erregung und Hemmung ist kritisch — zu viel Erregung kann zu Krampfanfällen führen, zu viel Hemmung dämpft Information und führt zu Funktionsverlust.
Rhythmische Aktivitäten wie Theta-, Alpha- oder Gamma-Oszillationen spiegeln koordinierte Aktionen großer Neuronengruppen wider und sind mit Kognition, Aufmerksamkeit und Gedächtnis verknüpft. Synchronität ermöglicht zuverlässige Informationsübertragung und kann die Plastizitätsregeln modulieren.
Beispiel-Tabelle 2: Typische Schaltkreise und ihre Funktionen
| Nr. | Schaltkreistyp | Funktion |
|---|---|---|
| 1 | Feedforward | Signalweiterleitung mit geringer Rückkopplung, z. B. sensorische Hierarchien |
| 2 | Feedback | Regulierung und Modulation, z. B. Aufmerksamkeit |
| 3 | Rekurrente Netzwerke | Gedächtnisbildung, Mustervervollständigung |
| 4 | Hemm-Exzitator Balance | Stabilisierung und Kontrastverstärkung |
Messen und Modulieren: Wie Wissenschaftler Neuronen untersuchen
Das Studium von Neuronen verwendet eine beeindruckende Palette an Methoden: von direkten Messungen wie Patch-Clamp-Elektrophysiologie, die einzelne Ionenkanäle sichtbar macht, über Calcium-Imaging zur Beobachtung von Aktivitätsmustern in Populationen bis hin zu bildgebenden Verfahren wie fMRI, die indirekte Signale großer Netzwerke misst. Optogenetik hat die Möglichkeit eröffnet, gezielt bestimmte Neuronenpopulationen mit Licht zu steuern, indem lichtempfindliche Ionenkanäle (z. B. Channelrhodopsin) exprimiert werden.
In vitro-Präparate, Tierversuche und zunehmend auch organoide Kulturen von menschlichem Gewebe erlauben Einsichten in Entwicklungsdynamiken, Krankheitsmechanismen und pharmakologische Interventionen. Computational Neuroscience ergänzt diese Methoden, indem Modelle gebaut werden, die die Dynamik einzelner Neuronen bis hin zu großen Netzwerken simulieren.
Liste 3: Wichtige experimentelle Methoden
- Patch-Clamp-Elektrophysiologie (Zell- und Ein-Kanal-Messungen)
- Calcium- und spannungsabhängiges Fluoreszenz-Imaging
- Optogenetik und Chemogenetik
- fMRI, PET, EEG/MEG
- Computationale Modellierung (Hodgkin-Huxley, Integrate-and-Fire und Deep Learning)
Erkrankungen des Nervensystems: Wenn Neuronen nicht richtig funktionieren
Viele neurologische und psychiatrische Erkrankungen beruhen auf Fehlfunktionen von Neuronen oder ihren Netzwerken. Alzheimer-Krankheit ist charakterisiert durch synaptischen Verlust, Plaques und Tau-Pathologie, Parkinson durch den Verlust dopaminerger Neurone, Epilepsie durch exzessive Synchronisation exzitatorischer Netzwerke, und psychische Störungen wie Depression oder Schizophrenie haben komplexe neurochemische und vernetzte Grundlagen. Entzündungen, Autoimmunprozesse, genetische Mutationen in Ionenkanälen (Channelopathien) und toxische Einflüsse verändern die normale Funktion von Neuronen.
Das Verständnis der neuronalen Mechanismen hilft, zielgerichtete Therapien zu entwickeln: Medikamente, die Neurotransmitter modulieren, tiefe Hirnstimulation, gentherapeutische Ansätze und Zelltransplantationen sind einige der Richtungen, in denen Forschung und Klinische Praxis zusammenkommen.
Vom Neuron zur künstlichen Intelligenz: Inspiration und Unterschiede
Neuronen haben die Entwicklung künstlicher neuronaler Netze inspiriert, doch die Umsetzung in Silizium ist stark abstrahiert. Künstliche Neuronen rechnen einfache gewichtete Summen und wenden Aktivierungsfunktionen an; biologische Neuronen integrieren elektrische Signale über Zeit und Raum, arbeiten mit Ionen, komplexen Rezeptorkaskaden und adaptiven Veränderungen. Trotzdem liefern biologische Prinzipien wie Hebb’sche Lernregeln, sparsames Kodieren und modulare Architektur wertvolle Hinweise für energieeffiziente und robuste KI-Systeme. Neuromorphe Hardware versucht zudem, die physikalische Effizienz biologischer Netzwerke nachzubilden, indem sie Ereignis-getriebene Architekturen verwendet.
Ein Blick in die Zukunft: Was können wir erwarten?
Die Zukunft wird von besseren Auflösungen, multimodalen Messungen und einer engeren Integration von Biologie und Technologie geprägt sein. Personalisierte Medizin könnte auf neuronalen Profilen beruhen; Brain-Computer-Interfaces könnten direkte Kommunikationskanäle öffnen; und neuromorphe Systeme könnten Energieprobleme der heutigen KI mindern. Gleichzeitig bleiben ethische Fragen offen: Wie gehen wir mit Eingriffen in das Gehirn um? Wer kontrolliert neuronale Daten? Diese sozialen Aspekte sind Teil des großen Puzzles.
Praktische Experimente und Demonstrationen für Einsteiger
Für Lernende und Enthusiasten gibt es einfache, sichere Experimente, die das Verständnis vertiefen. Modellrechnungen mit Hodgkin-Huxley-ähnlichen Simulationspaketen, Visualisierungen von Aktionspotentialen in Online-Simulatoren oder einfache Laborübungen mit C. elegans oder neuronalen Zellkulturen (unter Aufsicht) eröffnen direkte Erfahrungen. Workshops in Optogenetik und neuronaler Bildgebung sind inzwischen häufiger zugänglich und ermöglichen spannende Einblicke.
Liste 4: Einsteigeraktivitäten zum Verstehen neuronaler Prinzipien
- Online-Simulation eines Aktionspotentials (z. B. Neuron, HH-Simulatoren)
- Lesen und Diskutieren eines populärwissenschaftlichen Artikels über synaptische Plastizität
- Teilnahme an einem Laborkurs oder Workshop zu elektrophysiologischen Techniken
- Experimentieren mit einfachen neuronalen Netzen in Python (z. B. mit TensorFlow oder PyTorch)
Ethik, Gesellschaft und die Bedeutung neuronaler Forschung
Die Erforschung von Neuronen berührt nicht nur medizinische Fragen, sondern auch philosophische und gesellschaftliche Themen: Was macht Bewusstsein aus? Wie definiert man Identität, wenn neuronale Netzwerke veränderbar sind? Technologien, die direkt mit dem Gehirn interagieren, versprechen viel Nutzen — von der Wiederherstellung gelähmter Gliedmaßen bis zur möglichen Manipulation von Erinnerung — zugleich bergen sie Risiken für Privatsphäre und Autonomie. Eine verantwortungsvolle Forschungspraxis, transparente Regulierung und öffentliche Debatte sind daher unerlässlich.
Schlussfolgerung:
Schlussfolgerung
Das Verständnis eines Neurons ist eine Reise durch Biologie, Physik, Chemie und Informatik zugleich: von der grundlegenden Zellarchitektur über elektrochemische Vorgänge bis hin zu komplexen Netzwerken, die Denken und Fühlen ermöglichen. Neuronen sind vielseitig, anpassungsfähig und energetisch effizient — Eigenschaften, die sowohl die Medizin als auch die Technologie inspirieren. Indem wir ihre Mechanismen entschlüsseln, gewinnen wir nicht nur Einsicht in Krankheiten, sondern auch in das Wesen des Lernens und der Erinnerung. Die Forschung steht weiterhin vor großen Herausforderungen, aber auch vor faszinierenden Chancen, und sie verlangt neben technischer Exzellenz stets auch ethisches Bewusstsein und gesellschaftliche Verantwortung.